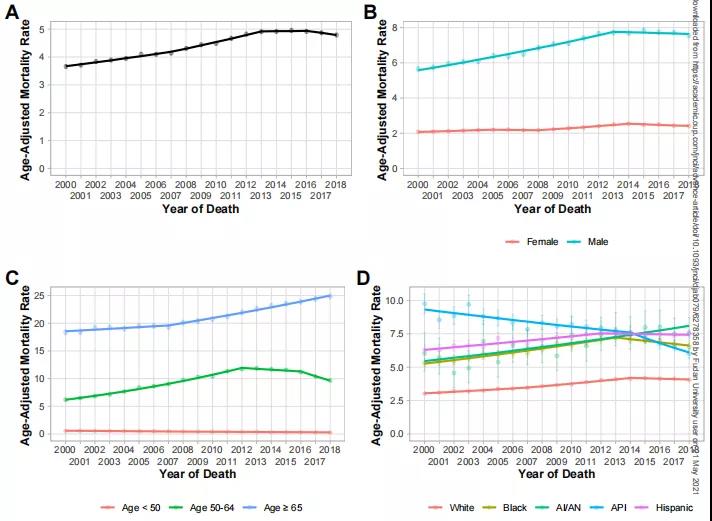
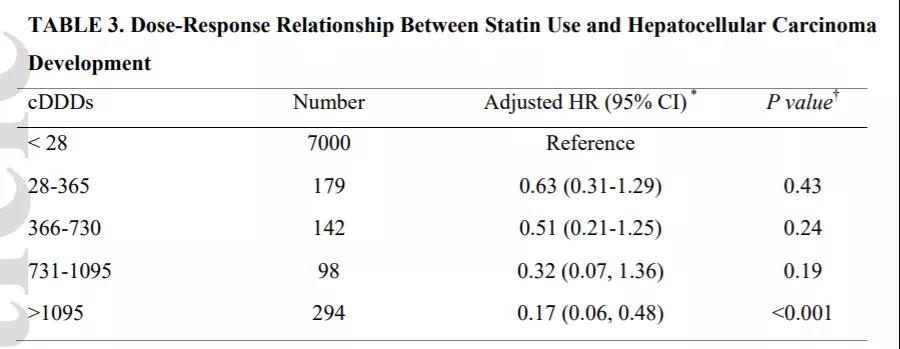
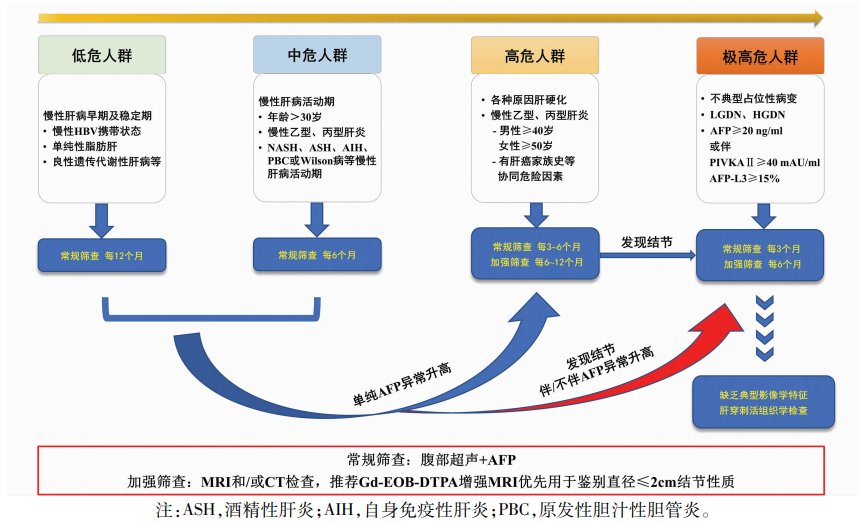
基于III期IMbrave150研究结果,美国FDA于2020年5月29日批准了阿替利珠单抗联合贝伐珠单抗治疗既往未接受全身治疗的不可切除或转移性HCC患者。这是自2007年以来,作为肝癌一线治疗的一种新疗法的OS首次超过索拉非尼。
IMbrave150试验共纳入了501例既往未接受过系统性治疗的HCC患者,所有患者随机分组,分别接受贝伐单抗(A)+阿替利珠单抗(T)或索拉非尼单药治疗。研究主要终点为总生存期(OS)和无进展生存期(PFS),次要终点为客观反应率(ORR)和反应持续时间(DOR)。
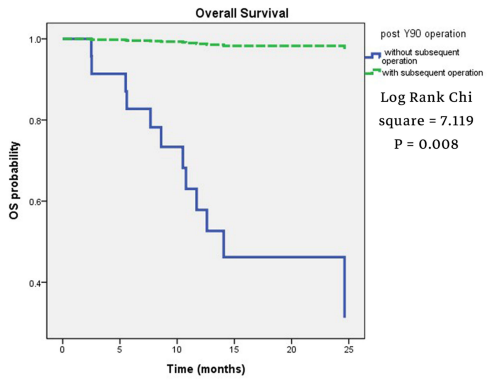
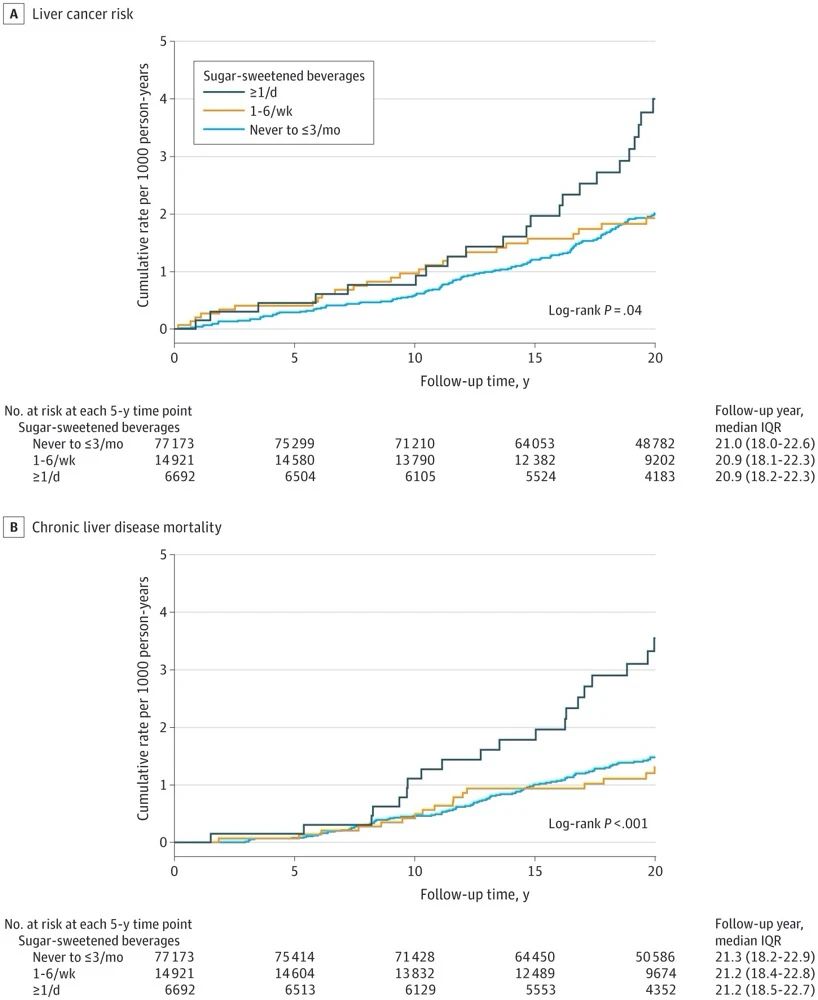
研究结果表明,两组患者(A+T vs 索拉非尼)的中位OS为NE vs 13.2m,6个月OS率为84.8% vs 72.2%,一年OS率为67.2% vs 57.6%;中位PFS为6.8 m vs 4.3 m;6个月PFS率为54.5% vs 37.2%。ORR为27.3% vs 11.9%( RECIST 1.1),“A+T”组共有18例(5.5%)患者达到完全缓解(CR);DCR为73.6% vs 55.3%;DOR≥6个月的患者比例为87.6% vs 59.1%。


值得注意的是,这项研究也公布了中国亚组的数据。在患者整体有着更高的乙肝感染率、大血管侵犯/肝外转移、甲胎蛋白≥400ng/ml等多种预后不良因素的状态下,中国亚组患者OS为NE vs 11.4m(HR=0.44),降低了56%的死亡风险,患者6个月生存率达到87%,疗效比试验整体人群更出色!

Ⅲ期IMbrave研究的进行是基于GO30140研究的初期有效结果。这是一项基于国际多中心、开放标签的Ⅰb期临床试验,研究采用篮式设计,其中A组为单臂研究,观察阿替利珠单抗+贝伐珠单抗(A+T)联合治疗在不可切除肝癌、晚期肝癌患者一线治疗中的安全性和有效性。研究表明,A组患者的ORR为36%,mPFS为7.3个月,mOS为17.1个月;F组为对照研究,患者分别接受“A+T”联合治疗或阿替利珠单抗单药治疗,研究结果显示“A+T”联合用药相比阿替利珠单抗单药治疗,明显改善患者的PFS,分别为5.6 vs 3.4个月,ORR分别为20% vs17%。相较于索拉非尼、仑伐替尼的上市数据,“A+T”方案无论是在ORR 还是OS方面,都取得了显著且有临床意义的改善!

IMbrave150研究在肝癌治疗领域中意义重大。自从索拉非尼被批准用于肝癌一线治疗后,近十几年来,经过多方努力,肝癌一线治疗领域只成功开发出来一款多靶点抑制剂——仑伐替尼,而且仑伐替尼的疗效只是不劣于索拉非尼而并不是优于索拉非尼。IMbrave150研究是首次采用联合治疗方案(A+T)与标准一线治疗药物索拉非尼进行头对头比较,结果显示,“A+T”的疗效是绝对优于索拉非尼的。就生存获益而言,在全球人群对照组中,索拉非尼中位OS为13.2个月,而“A+T”组未达到,HR为0.58,“A+T”治疗降低了42%的死亡风险。在PFS方面,“A+T”组则延长了2.5个月,达到了6.8个月(HR=0.59),降低了41%的肿瘤进展风险。亚洲人群肝癌患者更多有乙肝、肝硬化背景,预后相对更差。IMbrave150研究的中国亚组中,索拉非尼组中位OS为11.4个月,“A+T”组中位OS尚未达到,但HR更令人惊喜,达到了0.44,即降低了56%的死亡风险。此外,从安全角度来说,完全超乎意料,两药联合的方案实际跟单药的索拉非尼对比之后,它的安全性也令人非常满意,并没有出现一些更严重的副作用;而且最重要的是,两药联合方案,对病人的生活质量方面的评估结果表明,可明显改善患者的生活质量。也就是说,患者在用药过程中,不仅增加了生存期,同时也提高了生活质量,这是本研究非常有意义的一个突破点。